药监局修订缬沙坦国标 限定致癌物含量
曾引爆华海药业“毒素门”,致其一月内市值蒸发60亿;规定致癌物含量限度不得过千万分之三
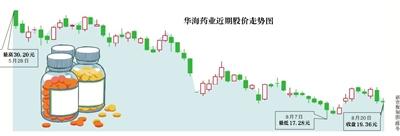
华海药业“毒素门”事件引发了监管对缬沙坦降压药含毒性杂质的高度关注。8月20日,国家药监总局发布《缬沙坦公示稿》,拟修订缬沙坦国家标准。在新修改的内容中,国家药监总局指出,必须对生产工艺进行评估以确定形成N-亚硝基二甲胺(NDMA)的可能性,必要时,需对生产工艺进行验证以说明在成品中N-亚硝基二甲胺的含量符合规定,限度不得过千万分之三。
华海药业多国召回缬沙坦降压药
药监局拟修订国标限定缬沙坦毒性杂质含量,对降压药的高度重视,源于发生在一个月前的华海药业“毒素门”事件。
7月8日晚间,华海药业发布公告称,公司在对缬沙坦原料药生产工艺进行优化评估的过程中,在未知杂质项下,发现并检定其中一未知杂质,N-亚硝基二甲胺。经调查该杂质系缬沙坦生产工艺产生的固有杂质,含量极微。不过公司坦言,该杂质含有基因毒性。
而记者查阅发现,去年10月,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,N-亚硝基二甲胺在2A类致癌物清单中。
据了解,华海药业生产的缬沙坦主要用于治疗轻、中度原发性高血压,当时,公司缬沙坦原料药主要销往北美、欧洲、印度、俄罗斯和南美等市场。2017年度,华海药业缬沙坦原料药销售金额为人民币3.28亿元。
在获悉华海药业相关事宜后,欧洲药品管理局、德国、意大利、芬兰、奥地利、日本等多个国家相继发布了召回公告。欧洲药品管理局在7月时称已经开始审查含有浙江华海药业股份有限公司的缬沙坦原料药(API)的制剂,在审查期间,欧盟相关国家的政府也正在召回含有该公司提供的缬沙坦原料药的制剂。
但事情并未就此结束,7月13日、16日,华海药业两度发布公告称,经检测,公司销售的缬沙坦原料药也涉及国内,公司决定主动召回在国内外上市的缬沙坦原料药。
同为缬沙坦的生产方,润都股份与天宇股份也受到波及。
8月5日,润都股份发布公告称,生达制药公司将润都股份供应的缬沙坦原料药送第三方单位检验,检出极微量N-亚硝基二甲胺成分,决定下架回收含有该成分的四项药品,暂停该药的生产。对此,润都股份进行了自检,用检验方法的定量限为0.08ppm,低于国家暂定标准。
8月6日,天宇股份发布公告称,在与中国台湾宇直泰贸易股份有限公司沟通后,公司得知其中2批缬沙坦原料药检出N-亚硝基二甲胺。
各地区NDMA限度标准纷纷出台
值得一提的是,华海药业在多份公告中曾反复强调,华海药业生产工艺已获得相关国家注册部门的批准;在公司发现该杂质时,各国监管部门尚未对N-亚硝基二甲胺杂质制定可接受控制限度的行业标准;公司缬沙坦原料药的工艺变更均经过各国药监部门批准,在符合法规标准的前提下合规生产。
根据国家药监总局公示稿显示,本次拟修订缬沙坦药典标准的上一个版本位于《中国药典》2015年版二部第1547页。记者查阅发现,在本书的第1547页-1549页中,分别记载了缬沙坦、缬沙坦片和缬沙坦胶囊的释义,三者的释义均未提及N-亚硝基二甲胺的限度问题。
而在“毒素门”事件发生后,7月29日,国家药监总局新闻发言人回应此事时表示,国家药监局与欧洲EMA、美国FDA等保持密切沟通和联系,及时关注国际监管机构发布的风险评估公告和动态,同时组织专家开展风险评估。“经研判,根据毒理学数据推算N-亚硝基二甲胺的每日最大摄入限量为0.1g,相当于欧洲EMA暂定参考限定值0.3ppm(按每日服用320mg缬沙坦计算)”。